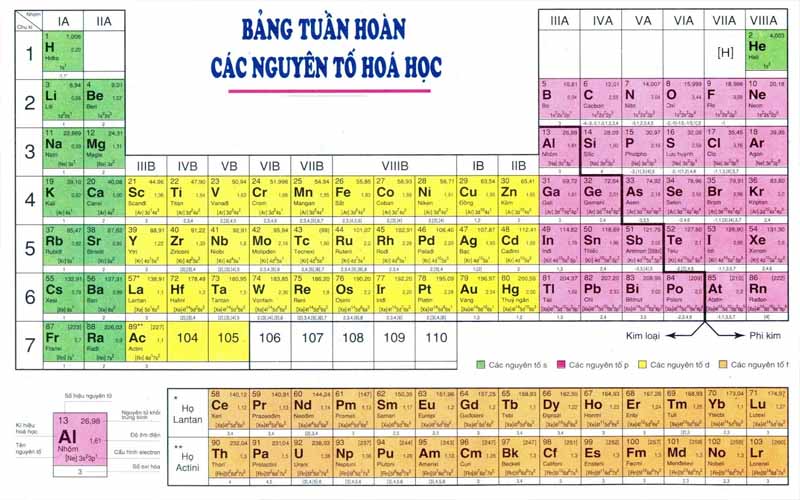
Bảng tuần hoàn các nguyên tố hóa học là một trong những chuyên đề trọng điểm của môn Hóa học trong chương trình trung học cơ sở và trung học phổ thông. Tuy nhiên để bạn ghi nhớ và áp dụng tốt bảng tuần hoàn các nguyên tố cần phải cần đến một phương pháp học hay. Sau đây là tổng hợp bảng tuần hoàn các nguyên tố hóa học 8 9 10 mới nhất cùng cách học hiệu quả.
Lịch sử phát minh bảng tuần hóa các nguyên tố hóa học
Bảng tuần hóa các nguyên tố hóa học trải qua các cột mốc lịch sử quan trọng sau đây:
-
Từ thời Trung cổ, con người đã biết đến các nguyên tố vàng, bạc, đồng, chì, sắt, thuỷ ngân, lưu huỳnh.
-
1869, 63 nguyên tố được tìm ra, nhưng các nhà khoa học vẫn chưa lý giải được mối quan hệ giữa chúng.
-
1817, J. Dobereiner nhận thấy khối lượng nguyên tử của stronti ở giữa khối lượng nguyên tử của bari và canxi, bộ ba nguyên tố đầu tiên này có tính chất tương tự nhau.
-
1862, nhà địa chất Pháp De Chancourtois đã sắp xếp các nguyên tố hoá học theo chiều tăng của khối lượng nguyên tử lên một bằng giấy. Ông nhận thấy tính chất của các nguyên tố giống như tính chất của các con số, và chúng lặp lại sau mỗi 7 nguyên tố.
-
1864, nhà Hóa học Anh John Newlands đã tìm ra quy luật: Mỗi nguyên tố đều thể hiện tính chất tương tự như nguyên tố thứ 8 khỉ xếp theo khối lượng nguyên tử tăng dần.
-
1869, nhà bác học người Nga Dmitri Mendeleev đã công bố bản “bảng tuần hoàn các nguyên tố hoá học” đầu tiên. Nhà khoa học người Đức Lothar Mayer cũng đã đưa ra một bảng tuần hoàn các nguyên tố hoá học tương tự năm 1870.
Việc phát hiện định luật tuần hoàn này đã khai phá được bí mật của thế giới vật chất, khiến các nhà hóa học có được một vũ khí mạnh mẽ, có ý nghĩa quan trọng với sự phát triển của các ngành quang học vật lý học nguyên tử sau này.
Tính đến tháng 9 năm 2021, bảng tuần hoàn hóa học có tất cả 118 nguyên tố đã được xác nhận, bao gồm các nguyên tố từ 1 (Hidro) tới 118 (Oganesson).
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn hóa học
Trong bảng tuần hoàn các nguyên tố hoá học, các nguyên tố được sắp xếp theo 3 nguyên tắc như sau:
-
Nguyên tắc 1: Các nguyên tố xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
-
Nguyên tắc 2: Các nguyên tố giống nhau về lớp electron trong nguyên tử được xếp thành một hàng.
-
Nguyên tắc 3: Các nguyên tố có cùng số electron hóa trị trong nguyên tử được sắp xếp vào một nhóm. Electron hóa trị là những electron có khả năng tham gia hình thành liên kết hóa học (electron lớp ngoài cùng hoặc phân lớp kế ngoài cùng chưa bão hòa).
Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Hiện tại, bảng hệ thống tuần hoàn hóa học đã hoàn thiện với 118 nguyên tố. Các nguyên tố sẽ được sắp xếp từ trái qua phải, từ trên xuống dưới theo quy luật thứ tự tăng dần số hiệu nguyên tử. Vậy cấu tạo của bảng tuần hoàn các nguyên tố hóa học gồm có những gì?
Ô nguyên tố
Mỗi nguyên tố hóa học được xếp vào một ô của bảng gọi là ô nguyên tố. Số thứ tự của ô nguyên tố bằng số hiệu nguyên tử của nguyên tố đó.
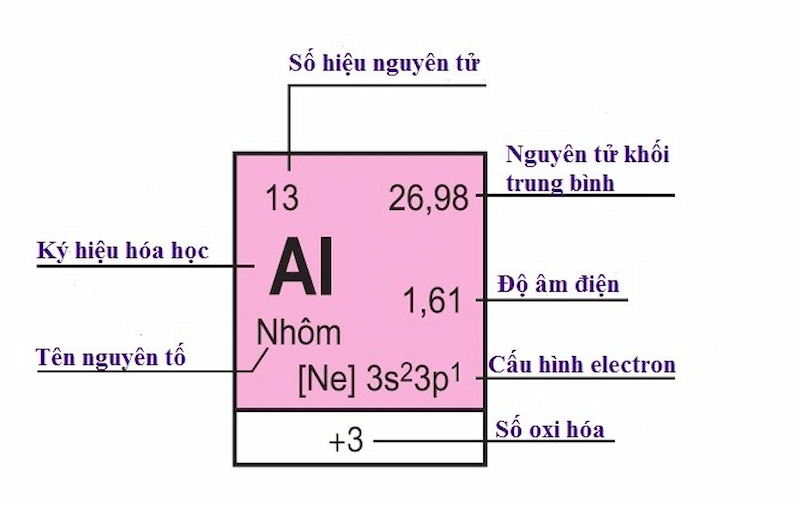
Ví dụ:
Nhôm (Al) chiếm ô 13 trong bảng tuần hoàn, vậy:
-
Số hiệu nguyên tử của Al là 13, số đơn vị điện tích hạt nhân là 13.
-
Số đơn vị điện tích hạt nhân là 13
-
Trong hạt nhân có 13 proton và vỏ nguyên tử của Al có 13 e.
Chu kì
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhân tăng dần. Trong bảng tuần hoàn gồm 7 chu kỳ:
-
Chu kì 1: Gồm 2 nguyên tố H (Z=1) đến He (Z=2).
-
Chu kì 2: Gồm 8 nguyên tố Li (Z=3) đến Ne (Z=10).
-
Chu kì 3: Gồm 8 nguyên tố Na (Z=11) đến Ar (Z=18).
-
Chu kì 4: Gồm 18 nguyên tố K (Z=19) đến Kr (Z=36).
-
Chu kì 5: Gồm 18 nguyên tố Rb (Z=37) đến Xe (Z=54).
-
Chu kì 6: Gồm 32 nguyên tố Cs (Z=55) đến Rn (Z=86).
-
Chu kì 7: Bắt đầu từ nguyên tố Fr (Z=87) đến nguyên tố có Z=110, đây là một chu kì chưa hoàn thành.
Phân loại chu kì
-
Chu kì nhỏ: Các chu kì 1,2,3.
-
Chu kì lớn: Các chu kì 4,5,6,7.
Như vậy, chu kỳ được bắt đầu bằng 1 kim loại kiềm và kết thúc bằng 1 khí hiếm. Số thứ tự của chu kỳ bằng số lớp electron trong nguyên tử.
Lưu ý: Hai hàng cuối bảng là 2 họ nguyên tố có cấu hình e đặc biệt:
Các bài viết không thể bỏ lỡ

Hóa học là gì? Hóa học có vai trò như thế nào trong cuộc sống?
Định luật bảo toàn khối lượng: Khái niệm, nội dung và áp dụng

Quy tắc hóa trị là gì? Vận dụng quy tắc hóa trị như thế nào?
Nhóm nguyên tố
Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được sắp xếp thành một cột.
Bảng tuần hoàn các nguyên tố hóa học được phân loại thành 8 nhóm A (đánh số từ IA đến VIIIA) và 8 nhóm B (đánh số từ IB đến VIIIB). Trong đó, mỗi nhóm là một cột, riêng nhóm VIIIB gồm 3 cột. Nguyên tử các nguyên tố trong cùng một nhóm có số electron hóa trị bằng nhau và bằng số thứ tự của nhóm (trừ hai cột cuối của nhóm VIIIB).
Nhóm A:
-
Nhóm A gồm 8 nhóm từ IA đến VIIIA.
-
Các nguyên tố nhóm A gồm nguyên tố s và nguyên tố p:
- Nguyên tố s: Nhóm IA (nhóm kim loại kiềm, trừ H) và nhóm IIA (kim loại kiềm thổ).
- Nguyên tố p: Nhóm IIIA đến VIIIA (trừ He).
-
STT nhóm bằng số e lớp ngoài cùng và bằng số e hóa trị
Cấu hình electron hóa trị tổng quát của nhóm A:
⟶ nsanpb
⟶ ĐK: 1≤a≤2; 0≤b≤6
Số thứ tự của nhóm A=a+b
⟶ Nếu a+b≤3 ⇒ Kim loại
⟶ Nếu 5≤a+b≤7 ⇒ Phi kim
⟶ Nếu a+b=8 ⇒ Khí hiếm
Ví dụ:
⟶Na(Z=11):1s22s22p63s1⇒IA
⟶O(Z=8):1s22s22p4⇒VIA
Nhóm B:
Nhóm B gồm 8 nhóm được đánh số từ IIIB đến VIIIB, IB và IIB theo chiều từ trái sang phải trong bảng tuần hoàn.
-
Nhóm B chỉ gồm các nguyên tố của các chu kỳ lớn.
-
Nhóm B gồm các nguyên tố d và nguyên tố f (thuộc 2 hàng cuối bảng).
-
STT nhóm bằng số e lớp ngoài cùng và bằng số e hóa trị (Trường hợp ngoại lệ: Số e hóa trị = 9, 10 thuộc nhóm VIIIB)
Cấu hình electron hóa trị tổng quát của nhóm B:
⟶ (n−1)dansb
⟶ ĐK: b=2; 1≤a≤10
Số thứ tự của nhóm:
⟶ Nếu a+b < 8 ⇒ STT nhóm = a+b
⟶ Nếu a+b = 8,9,10 ⇒ STT nhóm = 8
⟶ Nếu a+b > 10 ⇒ STT nhóm = (a+b)−10
>> Xem bảng tuần hoàn các nguyên tố hóa học đầy đủ, rõ nét nhất: TẠI ĐÂY
Sự biến đổi tính chất của các nguyên tố trong bảng tuần hoàn hóa học
Trong một chu kì (theo chiều tăng của điện tích hạt nhân) và trong một nhóm (theo chiều từ trên xuống dưới) có sự biến đổi tính chất được lặp lại ở các chu kì khác, nhóm khác theo cùng quy luật dưới đây. (Như hình minh họa)
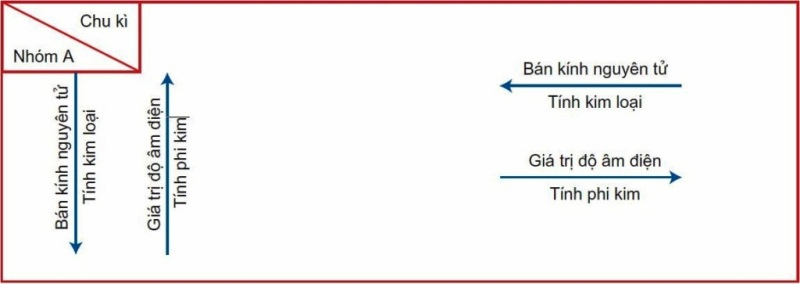
Trong một chu kì
Trong một chu kì, khi đi từ đầu chu kì đến cuối chu kì theo chiều tăng dần của điện tích hạt nhân, các nguyên tố trong bảng tuần hoàn hóa học có sự biến đổi như sau:
-
Số electron lớp ngoài cùng của nguyên tử tăng dần từ 1 đến 8 electron.
-
Tính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim của các nguyên tố tăng dần. Đầu chu kì là một kim loại kiềm, cuối chu kì là halogen, kết thúc chu kì là một khí hiếm.
Ví dụ:
Trong chu kì 2, 3 ta nhận thấy:
-
Chu kì 2: Gồm 8 nguyên tố.
-
Số electron lớp ngoài cùng của nguyên tử các nguyên tố trong chu kì 2 tăng dần từ 1 đến 8 (Li ở nhóm I, Ne ở nhóm VIII).
Có thể bạn quan tâm
- Ổi ruột đó bao nhiêu calo?
- Thế giới có bao nhiêu đất nước
- Sữa mic điện thoại mất bao nhiêu tiền?
- 1 cây sắt 20 nặng bao nhiêu kg?
- Có bao nhiêu ancol C 5 H 12 OH khi tách nước chỉ tạo một anken duy nhất
-
Tính kim loại giảm dần và tính phi kim tăng dần: Đầu chu kì là một kim loại mạnh (Li), cuối chu kì là một phi kim mạnh (F), kết thúc chu kì là một khí hiếm (Ne).
Nhóm
IA
Na
IIA
Mg
IIIA
Al
IVA
Si
VA
P
VIA
S
VIIA
Cl
Tính
Chất
Kl
điển
hình
Kl
mạnh
Kl
Pk
yếu
Pk
TB
Pk
mạnh
Pk
điển hình
Kim loại
Phi kim
Ngoài ra, trong một chu kì, các nguyên tố trong bảng tuần hoàn hóa học còn có sự biến đổi tính chất:
(Độ âm điện của một nguyên tử là đại lượng đặc trưng cho khả năng hút electron của nguyên tử đó khi tạo thành liên kết hóa học.)
-
Tính bazơ của các oxit và hiđroxit: Giảm dần theo chiều tăng của điện tích hạt nhân, đồng thời tính axit của chúng tăng dần.
-
Hóa trị: Trong cùng chu kì, khi điện tích hạt nhân tăng, hóa trị cao nhất với oxi tăng từ 1 đến 7, hóa trị đối với hidro giảm từ 4 đến 1. Như vậy, hóa trị cao nhất của một nguyên tố với oxi, hóa trị với hiđro biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân.
Hóa trị đối với hidro = số thứ tự nhóm – hóa trị đối với oxi
Trong một nhóm
Trong một nhóm, khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân: Số lớp electron của nguyên tử tăng dần, tính kim loại của các nguyên tố tăng dần đồng thời tính phi kim của các nguyên tố giảm dần.
Ví dụ:
Trong nhóm I và nhóm VII, ta quan sát được:
Nhóm I: Gồm 6 nguyên tố từ Li đến Fr.
-
Số lớp electron tăng dần từ 2 đến 7.
-
Số electron lớp ngoài cùng của nguyên tử đều bằng 1.
-
Tính kim loại của các nguyên tố tăng dần: Đầu nhóm, Li là kim loại mạnh, đến cuối nhóm Fr là kim loại cực mạnh.
Nhóm VII: Gồm 5 nguyên tố từ 5 đến At
-
Số lớp electron tăng dần từ 2 đến 6.
-
Số electron lớp ngoài cùng của nguyên tử đều bằng 7.
-
Tính phi kim giảm dần: Đầu nhóm, F là phi kim hoạt động hoá học rất mạnh. Đến cuối nhóm, I là phi kim hoạt động hoá học yếu hơn, At là nguyên tố không có trong tự nhiên nên ít được nghiên cứu.
Nhóm
IA
Na
IIA
Mg
IIIA
Al
IVA
Si
VA
P
VIA
S
VIIA
Cl
Tính chất
Kl điển hình
Kl mạnh
Kl
Pk yếu
Pk trung bình
Pk mạnh
Pk điển hình
Kim loại (Kl)
Phi kim (Pk)
Ngoài ra, trong một nhóm sắp xếp theo chiều tăng dần của điện tích hạt nhân, các nguyên tố trong bảng tuần hoàn hóa học còn có sự biến đổi tính chất như sau:
-
Độ âm điện: Giảm dần trong một nhóm, đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân.
-
Tính bazơ của các oxit và hiđroxit: Tăng dần theo chiều tăng của điện tích hạt nhân, đồng thời tính axit của chúng giảm dần.
Xem thêm:
- Cấu hình electron nguyên tử: Toàn bộ lý thuyết và cách viết cấu hình e đơn giản, dễ nhớ
- Nhóm halogen là gì? Vị trí, đặc điểm, tính chất, cấu hình electron
ý nghĩa quan trọng của bảng tuần hoàn các nguyên tố hóa học
Đến năm 2021, bảng tuần hoàn các nguyên tố hóa học được hoàn thiện với 118 nguyên tố được xác nhận. Được biết đến là một chuyên đề quan trọng của chương trình môn Hóa học nhưng ít người biết rằng bảng tuần hoàn hóa học ra đời mang ý nghĩa rất lớn trong sự phát triển của nhân loại.
-
Ứng dụng trong các công trình nghiên cứu: Không chỉ là một tài liệu cần thiết phục vụ trong học tập mà nó còn được ứng dụng trong các công trình nghiên cứu với kho tàng thông tin khổng lồ.
-
Tiền đề cho sự phát triển của lĩnh vực nguyên tử: Bên cạnh ứng dụng trong nhiều lĩnh vực khác nhau, bảng tuần hoàn các nguyên tố hóa học đã và đang tạo tiền đề cho sự phát triển mạnh mẽ của lĩnh vực nguyên tử.

Cụ thể, khi biết được vị trí của một nguyên tố và quy luật biến đổi tính chất của chúng trong bảng tuần hoàn, từ đó chúng ta có thể xác định nhanh chóng các thông tin sau:
-
Cấu tạo của nguyên tố đó và ngược lại.
-
Hóa trị cao nhất của nguyên tố đó với Oxi và Hidro. Từ đó, có thể xác định được công thức oxit cao nhất và hidroxit tương ứng, công thức hợp chất với Hidro,…
-
Những tính chất hóa học cơ bản của nguyên tố đó.
-
Dựa vào quy luật biến đổi tính chất của các nguyên tố trong bảng tuần hoàn, ta có thể so sánh tính chất hóa học của một nguyên tố với các nguyên tố lân cận.
Ví dụ: Lưu huỳnh (S) ở vị trí ô số 16 trong bảng tuần hoàn hóa học. Từ đó, ta có thể xác định các thông tin quan trọng:
-
Lưu huỳnh thuộc nhóm VI, chu kỳ 3 và là một phi kim.
-
Hóa trị cao nhất của lưu huỳnh khi kết hợp với Oxi là 6 và với Hidro là 2.
-
Công thức Oxit cao nhất của lưu huỳnh là SO3 và hợp chất với Hidro là H2S. Đây là một Oxit axit và axit tương ứng của nó là H2SO4 – một axit mạnh.
Các bài viết không thể bỏ lỡ

Hóa học là gì? Hóa học có vai trò như thế nào trong cuộc sống?
Định luật bảo toàn khối lượng: Khái niệm, nội dung và áp dụng

Quy tắc hóa trị là gì? Vận dụng quy tắc hóa trị như thế nào?
Cách học bảng tuần hoàn các nguyên tố hóa học đơn giản, dễ nhớ
Bảng tuần hoàn các nguyên tố hóa học là một trong những kiến thức trọng điểm của chương trình Hóa học cấp 2 và cấp 3. Ghi nhớ bảng tuần hoàn sẽ giúp bạn đạt điểm tốt trong các bài thi quan trọng. Sau đây là cách học bảng tuần hoàn các nguyên tố hóa học đơn giản, dễ nhớ.
Cách học truyền thống
Với cách học truyền thống này, bạn có thể áp dụng hàng ngày để đạt được hiệu quả học tập cao nhất. Đừng quên phân chia thời gian hợp tập hợp lý nhé!
-
Nhận biết thành phần của mỗi nguyên tố: Một điều đáng lưu tâm nhất khi sử dụng bảng tuần hoàn hóa học là bạn đọc phải nhận biết được số nguyên tử, nguyên tử khối trung bình, độ âm điện, cấu hình e, số oxi hóa, tên nguyên tố và kí hiệu hóa học. Những thông tin này đều biểu thị trong ô nguyên tố trong bảng tuần hoàn.
-
Mỗi ngày học thuộc 1-3 nguyên tố: Đây là một phương pháp học được áp dụng phổ biến. Để ghi nhớ một bảng tuần hoàn hơn 100 nguyên tố với các thông số đi kèm, việc phân nhỏ bảng để học giúp não bộ ghi nhớ được một cách hiệu quả. Bên cạnh đó, bạn đừng quên ôn lại bài cũ khi học các nguyên tố mới tránh trường hợp quên.
-
Dán bảng tuần hoàn hóa học nơi bạn thường đi qua: Một cách làm khá mới mẻ được áp dụng để ghi nhớ bảng tuần hoàn hóa học là dán nó ở khắp mọi nơi bạn thường đi qua. Mặt khác, bạn có thể mang theo bảng tuần hoàn bên người, trong cặp sách để học khi rảnh rỗi.
-
Làm thẻ ghi chú cho mỗi nguyên tố: Hãy ghi nhớ chúng bằng cách tự làm thẻ ghi chú với màu sắc yêu thích. Một mặt ghi ký hiệu tên nguyên tố, một mặt ghi các thông tin liên quan… Cách học này sẽ giúp tăng độ hứng thú của bạn.

Sử dụng công cụ hỗ trợ trí nhớ
Sử dụng công cụ hỗ trợ trí nhớ là phương pháp ghi nhớ bảng tuần hoàn các nguyên tố được các thầy cô và học sinh sử dụng khá rộng rãi. Thay vì phải nhớ tên của từng nguyên tố, hãy sử dụng một vài mẹo ghi nhớ dễ dàng thông qua các câu nói dễ thuộc sau:
-
“Khi nào cần may áo giáp sắt nhớ sang phố hỏi cửa hàng Á Phi Âu”: Đây là câu nói về để ghi nhớ 16 nguyên tố hóa học trong dãy hoạt động hóa học. Tên các nguyên tố được “biến thể” linh hoạt dựa trên những chữ cái đầu tiên, tương ứng với: F, Na, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au.
-
“Lâu nay không rảnh coi phim”: Câu nói quen thuộc giúp ghi nhớ 6 nguyên tố hóa học nhóm IA: Li, Na, K, Rb, Cs, Pr.
-
Bài ca hóa trị cơ bản được truyền miệng rộng rãi:
Kali (K), Iot (I), Hidrô (H)
Natri (Na) với Bạc (Ag), Clo (Cl) một loài
Là hoá trị một (I) em ơi
Nhớ ghi cho kỹ kẻo thời phân vân
Magiê (Mg), Kẽm (Zn) với Thuỷ Ngân(Hg)
Oxi (O), Đồng (Cu), Thiếc(Sn) cùng gần Bari (Ba)
Cuối cùng thêm chú Canxi (Ca)
Hoá trị hai (II) nhớ có gì khó khăn
Bác Nhôm (Al) hoá trị ba(III) lần
In sâu trí nhớ khi cần có ngay
Cacbon (C), Silic (Si) này đây
Có hoá trị bốn(IV) không ngày nào quên
Sắt (Fe) kia lắm lúc hay phiền
Hai, ba lên xuống nhớ liền ngay thôi
Nitơ (N) rắc rối nhất đời
Một hai ba bốn, khi thời lên V
Lưu huỳnh (S) lắm lúc chơi khăm
Xuống hai lên sáu khi nằm thứ tư
Phot pho (P) nói đến không dư
Có ai hỏi đến thì ừ rằng năm
Em ơi, cố gắng học chăm
Bài ca hoá trị suốt năm cần dùng.
Chơi trò chơi
Bên cạnh phương pháp học truyền thống cùng mẹo ghi nhớ thú vị, chơi các trò chơi trực tuyến cũng là một cách ghi nhớ các nguyên tố hóa học hiệu quả! Những trò chơi kiến thức này có thể kiểm tra trí nhớ và cải thiện điểm số của bạn đáng kể trước những kỳ thi quan trọng đó!
Cách ghi nhớ bảng tuần hoàn các nguyên tố hóa học
Bên cạnh các phương pháp học tập trên, phương pháp học thuộc nhanh và áp dụng thành thạo bảng tuần hoàn các nguyên tố hóa học là thường xuyên giải các bài tập về hóa học, nghiên cứu sâu các nguyên tố hóa học.
Hãy nghiên cứu sâu và xác định bản chất các thành phần khác nhau của mỗi nguyên tố hóa học. Ghi nhớ và thành thạo 10 nguyên tố đầu tiên trong bảng (tất cả các thông tin có trong ô), bạn sẽ tự tìm ra quy luật cho các giá trị nguyên tố tiếp theo. Hãy sử dụng phương pháp so sánh với giá trị đã học. Dần dần như vậy, bạn sẽ nắm được hết thông tin về hơn 120 nguyên tố trong bảng tuần hoàn Mendeleev. Monkey chúc các bạn áp dụng được phương pháp học hiệu quả nhất và đạt được điểm cao trong kỳ thi!

Bài tập về bảng tuần hoàn các nguyên tố hóa học SGK Hóa học 9, 10 kèm lời giải
Trên đây là tổng hợp các kiến thức về bảng tuần hoàn các nguyên tố hóa học 8 9 10 mới nhất. Hãy áp dụng những kiến thức trên để giải một số bài tập Hóa học 9 và Hóa học 10 sau:
Giải bài tập bảng tuần hoàn các nguyên tố hóa học SGK Hóa học 9
Bài 1 (trang 101 SGK Hóa 9)
Dựa vào bảng tuần hoàn, hãy cho biết cấu tạo nguyên tử, tính chất kim loại, phi kim của các nguyên tố có số hiệu nguyên tử 7, 12, 16.
Gợi ý đáp án:
Số hiệu nguyên tử
Cấu tạo nguyên tử
Tính chất
Điện tích hạt nhân
Số e trong nguyên tử
Số lớp electron
Số e lớp ngoài cùng
Kim loại
Phi kim
7
7+
7
2
5
x
12
12+
12
3
2
x
16
6+
6
3
6
x
-
Giả sử nguyên tố A có số hiệu nguyên tử là 7 ⇒ A thuộc ô số 7 trong bảng tuần hoàn, có điện tích hạt nhân là 7+, có 7e.
-
Dựa vào bảng tuần hoàn ta thấy: Nguyên tố A thuộc chu kì 2 ⇒ có 2 lớp electron; thuộc nhóm V ⇒ Có 5 e lớp ngoài cùng và phi kim.
Tương tự với 2 nguyên tố còn lại ta được kết quả trong bảng.
Bài 2 (trang 101 SGK Hóa 9)
Biết X có cấu tạo nguyên tử như sau: Điện tích hạt nhân là 11+, 3 lớp electron, lớp ngoài cùng có 1 electron. Hãy suy ra vị trí của X trong bảng tuần hoàn và tính chất hoá học cơ bản của nó.
Gợi ý đáp án:
Điện tích hạt nhân là 11+ nên số thứ tự của nguyên tố là 11 ( ô số 11).
Có 3 lớp e ⇒ thuộc chu kì 3.
Có 1 e lớp ngoài cùng ⇒ thuộc nhóm I trong bảng tuần hoàn.
Tên nguyên tố là: Natri.
Kí hiệu hóa học: Na.
Nguyên tử khối: 23.
Bài 3 (trang 101 SGK Hóa 9)
Các nguyên tố trong nhóm I đều là những kim loại mạnh tương tự natri: Tác dụng với nước tạo thành dung dịch kiềm giải phóng hiđro, tác dụng với oxi tạo thành oxit, tác dụng với phi kim khác tạo thành muối … Viết các phương trình hóa học minh họa với kali.
Gợi ý đáp án:
Phương trình hóa học:
2K + 2H2O → 2KOH + H2
4K + O2 → 2K2O
2K + Cl2 → 2KCl.
Giải bài tập bảng tuần hoàn các nguyên tố hóa học SGK Hóa học 10
Giải Bài 1 trang 35 SGK Hóa 10
Các nguyên tố xếp ở chu kì 6 có số lớp electron trong nguyên tử là:
A. 3.
B. 5.
C. 6.
D. 7.
Chọn đáp số đúng.
Cần nhớ: Số thứ tự của chu kì bằng số lớp electron. Số thứ tự của nhóm bằng số e hóa trị
Gợi ý đáp án: C là đáp án đúng.
Giải Bài 2 Hoá 10 SGK trang 35
Trong bảng tuần hoàn các nguyên tố, số chu kì nhỏ và số chu kì lớn là:
A. 3 và 3.
B. 3 và 4.
C. 4 và 4.
D. 4 và 3.
Chọn đáp số đúng.
Gợi ý đáp án: B là đáp án đúng
Giải Bài 3 SGK Hóa 10 trang 35
Số nguyên tố trong chu kì 3 và 5 là:
A. 8 và 18.
B. 18 và 8.
C. 8 và 8.
D. 18 và 18.
Chọn đáp số đúng.
Gợi ý đáp án: A là đáp án đúng.
Giải Bài 4 trang 35 SGK Hóa 10
Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo nguyên tắc:
A. Theo chiều tăng của điện tích hạt nhân.
B. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng.
C. Các nguyên tố có cùng số electron hóa trị trong nguyên tử được xếp thành 1 cột.
D. Cả A, B, C.
Chọn đáp án đúng.
Gợi ý đáp án: D là đáp án đúng.
Giải Bài 5 Hoá 10 SGK trang 35
Tìm câu sai trong các câu sau đây:
A. Bảng tuần hoàn gồm có các ô nguyên tố, các chu kì và các nhóm.
B. Chu kì là dãy các nguyên tố mà những nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhân tăng dần.
C. Bảng tuần hoàn có 7 chu kì. Số thứ tự của chu kì bằng số phân lớp electron trong nguyên tử.
D. Bảng tuần hoàn có 8 nhóm A và 8 nhóm B.
Gợi ý đáp án: C là đáp án sai.
Giải Bài 6 trang 35 SGK Hóa 10
Hãy cho biết nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học.
Gợi ý đáp án:
a) Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân.
b) Các nguyên tố có cùng số lớp electron trong nguyên tử được sắp xếp thành một hàng.
c) Các nguyên tố có số electron hóa trị được xếp thành một cột.

Như vậy, bài viết này của Monkey đã cung cấp cho bạn tổng hợp kiến thức về bảng tuần hoàn các nguyên tố hóa học 8 9 10 mới nhất cùng cách ghi nhớ hiệu quả. Hy vọng qua những thông tin trên, bạn có thể học thuộc lòng hiệu quả bảng tuần hoàn các nguyên tố và vận dụng chúng để giải thành thạo bài tập trong các kỳ thi quan trọng. Truy cập website của Monkey mỗi ngày để cập nhập thêm nhiều bài học thú vị về các môn học Toán, Lý, Hóa nhé!